A legislação federal de Pagamentos Abertos de 2013, que exige que as empresas farmacêuticas divulguem seus pagamentos diretos aos médicos, deveria ajudar a combater a influência corruptora de tais pagamentos. Caso os pagamentos se tornassem públicos, como é a ideia, os professores da faculdade de medicina se esquivariam de servir como os autores nomeados em artigos escritos por fantasmas relatando resultados de ensaios clínicos, e eles se absteriam de ser pagos para dar palestras promocionais enquanto as empresas construíam mercados para seus medicamentos recém aprovados.
Os Centros de Serviços Medicare e Medicaid publicaram recentemente os pagamentos de 2020, e assim há agora um registro de sete anos de pagamentos que pode ser facilmente acessado. Uma investigação feita pelo Mad in America sobre esses registros revela que embora a legislação tenha de fato reduzido a participação de psiquiatras acadêmicos nessas atividades, a influência corruptora do dinheiro farmacêutico em todas as fases do processo de desenvolvimento de medicamentos – os testes de medicamentos, o relato de resultados em revistas e a venda de medicamentos recém-aprovados para a comunidade médica – está sempre presente. A corrupção hoje está mais arraigada do que nunca.
Na psiquiatria, existe agora o que poderia ser descrito como uma indústria de serviços psicofarmacológicos, que pode ser dividida em três setores. Há um pequeno número de psiquiatras acadêmicos que atuam como consultores e assessores de empresas ao realizarem seus estudos de fase II e fase III e, juntamente com os funcionários da empresa, atuam como autores nos relatórios publicados desses estudos. Há um segundo grupo, um pouco maior, de psiquiatras que escrevem revisões adicionais dos resultados das fases II e III e, ao fazê-lo, ajudam a promover uma maior percepção das novas drogas. O terceiro setor ajuda a comercializar as drogas para os prescritores. Os psiquiatras dos dois primeiros grupos falam em conferências e servem como “professores” para cursos de educação médica contínua, e seus esforços são complementados por um número muito maior de psiquiatras da comunidade que frequentam os círculos de jantares.
O resultado mais notável da legislação de Pagamentos Abertos é que as empresas farmacêuticas não estão mais tentando esconder esta influência financeira. A face do comércio é visível em todas as etapas do processo: o desenho tendencioso dos ensaios, a preparação dos resultados que favoreçam e a posterior distribuição das amostras-grátis aos médicos. Graças ao banco de dados de Pagamentos Abertos, a quantidade de dinheiro que flui para os psiquiatras em cada etapa pode agora ser relatada.
Há duas partes nesta investigação feita por nós do Mad. A primeira parte analisa a corrupção que levou o Congresso a aprovar a legislação de Pagamentos Abertos, e depois detalha o fluxo de dinheiro para os psiquiatras que pode ser coletado deste banco de dados. A segunda parte analisa como este processo comercial esteve presente nos testes e comercialização de sete novos medicamentos psicotrópicos que foram aprovados pela FDA de 2013 a 2017, e como este financiamento transformou regularmente medicamentos que não conseguiram fornecer um benefício clínico significativo em testes clínicos em medicamentos “seguros e eficazes” que geraram bilhões de receitas para as empresas farmacêuticas.
Primeira Parte
O caminho para pagamentos abertos
A Food and Drug Administration (FDA) começou a exigir que as empresas farmacêuticas provassem que seus medicamentos eram seguros e eficazes em 1962 e, durante as duas décadas seguintes, as empresas farmacêuticas contrataram regularmente médicos acadêmicos para dirigir seus estudos. Como os veteranos da indústria lembraram mais tarde, muitas vezes eles tinham que ir com “chapéu na mão” para pedir aos médicos acadêmicos que o fizessem. As bolsas dos Institutos Nacionais de Saúde eram a moeda do campo da saúde para os pesquisadores acadêmicos daquela época, não para o financiamento da indústria, e para que os pesquisadores acadêmicos pudessem conduzir seus estudos, as empresas farmacêuticas teriam que ceder o controle dos estudos a eles. Os pesquisadores acadêmicos projetariam os ensaios, analisariam os resultados e publicariam artigos sem interferência das empresas farmacêuticas.
Este muro de separação começou a derreter em 1980 quando o Congresso aprovou a lei Bayh-Dole, que permitiu que pesquisadores acadêmicos que haviam feito descobertas financiadas pelo NIH licenciassem suas descobertas a empresas farmacêuticas e cobrassem royalties. Os pesquisadores individuais podiam agora lucrar com a pesquisa financiada pelo NIH, e assim os pesquisadores acadêmicos tinham um novo motivo para colaborar com a indústria. Este impulso tornou-se mais pronunciado nos anos seguintes, quando se tornou mais difícil para os pesquisadores acadêmicos obterem bolsas do NIH.
Tudo isso ocorreu ao mesmo tempo em que a Associação Psiquiátrica Americana (APA), com sua publicação da terceira edição de seu Manual de Diagnóstico e Estatística (DSM III) em 1980, havia adotado um modelo de doença para classificar os transtornos mentais. Os interesses da psiquiatria como corporação e os da indústria farmacêutica estavam agora em perfeito alinhamento.
Com o novo modelo de doença da APA, as empresas farmacêuticas podiam obter a aprovação de medicamentos para uma gama muito mais ampla de dificuldades. O mercado de medicamentos psiquiátricos certamente iria se expandir drasticamente. Ao mesmo tempo, a psiquiatria estava agora abraçando a psicofarmacologia – em oposição às terapias faladas – como seu domínio principal. Os psiquiatras estavam agora tratando “doenças” cerebrais, com a prescrição de drogas como a sua função principal. Tanto a indústria quanto a psiquiatria, agindo à maneira de uma corporação, tinham motivos para vender novas drogas como seguras, eficazes e melhores do que os tratamentos existentes no mercado.
Nos anos 80, a APA começou a permitir que as empresas farmacêuticas patrocinassem palestras “educacionais” em sua conferência anual, com aquelas palestras dadas por psiquiatras acadêmicos que estavam sendo pagos pelas empresas. A APA e as empresas farmacêuticas até mesmo declararam publicamente que agora estavam em “parceria” para desenvolver novos medicamentos. O dinheiro farmacêutico fluía para a APA para diversos fins, e logo as empresas farmacêuticas estavam pagando psiquiatras acadêmicos para servirem como seus conselheiros, consultores e palestrantes.
A indústria farmacêutica lançou uma ampla rede com seus dólares, e este esforço foi tão completo que em 2000, quando o New England Journal of Medicine procurou encontrar um especialista para escrever um artigo de revisão sobre o tratamento da depressão, ele “encontrou muito poucos que não tinham laços financeiros com as empresas farmacêuticas”. Como o psiquiatra Daniel Carlat disse ao Boston Globe, “nosso campo como um todo está sendo progressivamente comprado de todas as maneiras pelas empresas farmacêuticas: isto inclui os diagnósticos, as diretrizes de tratamento e as reuniões nacionais”.
Durante a década seguinte, tornou-se evidente que esta “captura” da psiquiatria acadêmica pela indústria havia chegado a um grande custo para o público. Os antidepressivos ISRS e os antipsicóticos atípicos tinham sido apresentados ao público nos anos 90 como “medicamentos revolucionários”, mas acabou se tornando conhecido, pelo menos em certos círculos, que os resultados de ensaios clínicos dessas duas classes tinham sido utilizados para exagerar a sua eficácia, e os danos dos medicamentos tinham sido ocultados.
Em 2007, o senador de Iowa Charles Grassley começou a relatar a quantidade de dinheiro da indústria que fluía para psiquiatras acadêmicos que haviam trabalhado como consultores e servido em gabinetes de palestrantes, e ele deu nomes. Grassley falou dos pagamentos da indústria para Joseph Biederman, professor da Escola Médica de Harvard; para Melissa Del Bello, professora associada da Universidade de Cincinnati; para Karen Wagner, diretora de psiquiatria infantil da Universidade do Texas; e para Charles Nemeroff, presidente do departamento de psiquiatria da Escola Médica Emory. Frederick Goodwin, ex-diretor do Instituto Nacional de Saúde Mental (NIMH), foi revelado como tendo recebido mais de um milhão de dólares para promover um estabilizador de humor para a desordem bipolar.
Na esteira destas revelações, Grassley impulsionou uma legislação que previa a publicação de pagamentos da indústria aos médicos. A partir de 2009, empresas farmacêuticas individualmente começaram a publicar estes dados em seus websites, que foram reunidos pela ProPublica em relatórios anuais “Dollars for Doctors”. Então, em 2013, como parte da lei Obama Affordable Care Act, todas as empresas farmacêuticas e fabricantes de dispositivos foram obrigados a relatar pagamentos diretos aos médicos, com relatórios anuais devidos até 30 de junho do ano seguinte.
Esta ” Lei da Luz do Sol” deveria fornecer pelo menos um remédio parcial para a corrupção que se tornou uma preocupação pública. As revistas médicas também começaram a exigir que os autores de artigos revelassem quaisquer conflitos de interesse financeiros (mas não o valor.) Tal transparência tornaria os conflitos conhecidos e a ideia era de que isso produziria uma mudança de cenário para os testes de medicamentos em ensaios clínicos. Para proteger suas reputações, os médicos acadêmicos precisariam cortar seus laços financeiros com a indústria, e as empresas farmacêuticas seriam motivadas a pagar pesquisadores “independentes” para realizar seus estudos, pois isso daria mais credibilidade aos resultados publicados.
Mad in America (MIA) identificou 62 psiquiatras americanos que receberam pagamentos diretos de empresas farmacêuticas totalizando US$ 1 milhão ou mais de 2014 a 2020. O maior ganhador foi Stephen Stahl, que ganhou US$ 8,6 milhões, sendo que US$ 6,6 milhões vieram da Takeda, que trouxe o antidepressivo Brintellix para o mercado em 2013. Takeda lhe pagou US$ 3,3 milhões por sua promoção deste medicamento de 2014 a 2018.
Para compilar esta lista de milhões de dólares, o MIA pesquisou através de dois bancos de dados on-line: ProPublica’s Dollars for Docs for 2018 (que é o último ano disponível no site), e o banco de dados de Pagamentos Abertos de 2014 a 2020. Embora o banco de dados de Pagamentos Abertos não possa ser usado para gerar uma lista de psiquiatras classificados de cima para baixo pelo total recebido durante este período de sete anos, o site ProPublica pode fornecer tal lista para 2018. Assim, a MIA primeiro identificou uma lista de 150 psiquiatras que ganharam mais de $100.000 em 2018, e depois verificou o total que cada um ganhou de 2014 a 2020, de acordo com o banco de dados de Pagamentos Abertos.
Isso produziu uma lista de 62 psiquiatras que se tornaram o clube do milhão de dólares. Também realizamos uma amostragem de psiquiatras que foram pagos entre $50.000 e $100.000 em 2018 por seus serviços a empresas farmacêuticas, mas nenhum atingiu a marca de $1 milhão durante os sete anos. Além disso, utilizamos o banco de dados de Pagamentos Abertos para pesquisar os pagamentos das empresas farmacêuticas que trouxeram novos medicamentos ao mercado de 2013 a 2017 e identificamos os cinco ou seis psiquiatras que haviam sido mais pagos por cada empresa. Isso não nos deu nenhum nome novo para a lista.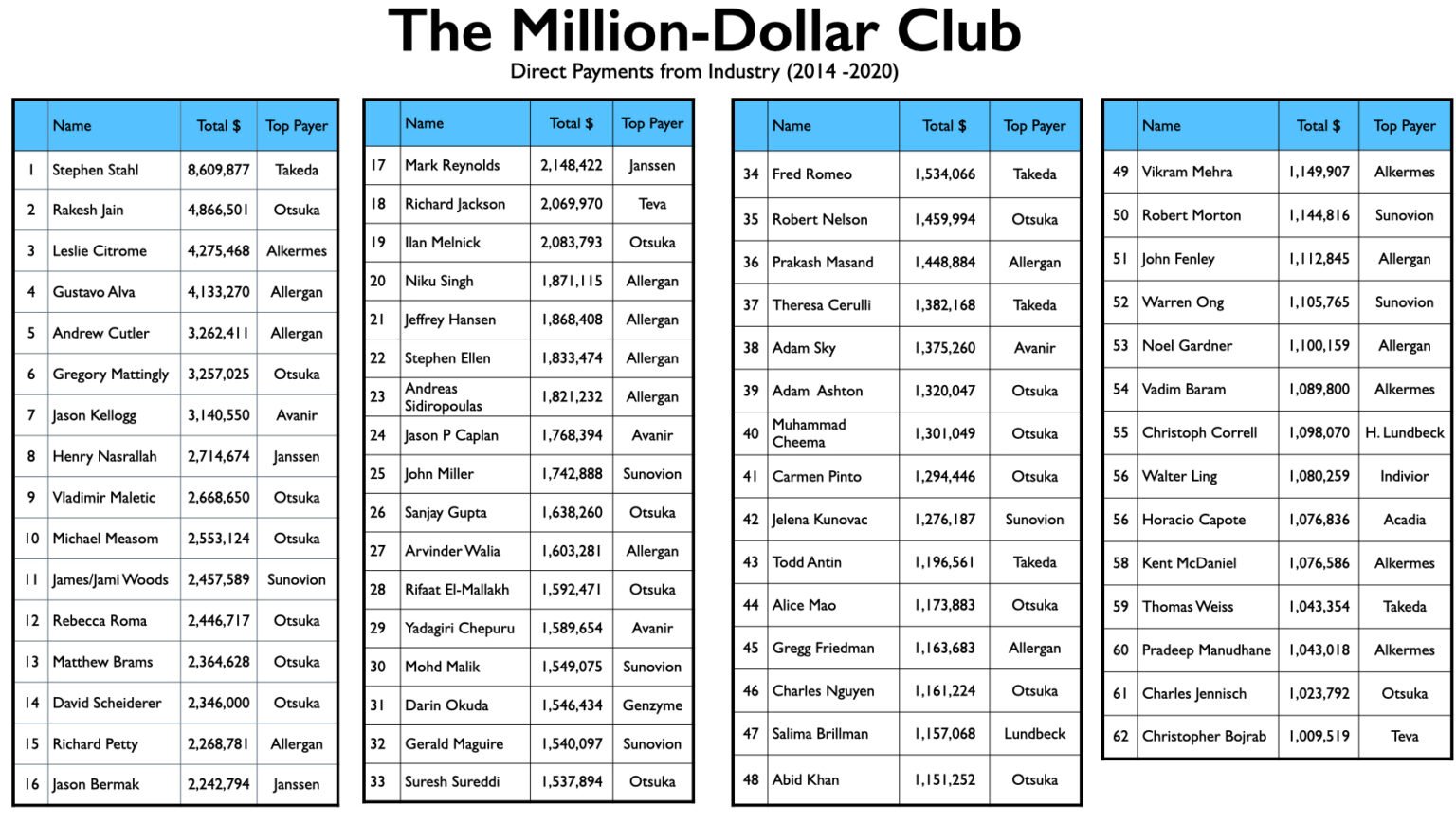
A lista de 62 nomes é notável pela relativa ausência de psiquiatras acadêmicos conhecidos por suas pesquisas. Na sua maioria, o clube de um milhão de dólares é composto por psiquiatras com consultas clínicas em escolas médicas, o que muitas vezes é comparado a servir como “adjunto” do corpo docente, e que têm consultórios particulares e trabalham na comunidade. Há poucos professores assalariados nas escolas médicas deste clube milionário, e há um número razoável de psiquiatras na lista que não têm nenhuma conexão com uma escola médica acadêmica.
Isto é verdade até mesmo para os 10 primeiros da lista. Não há docentes assalariados neste grupo. Sete dos dez que fazem consultas clínicas em escolas médicas, um é professor emérito e dois não têm nenhuma afiliação atual com uma escola médica.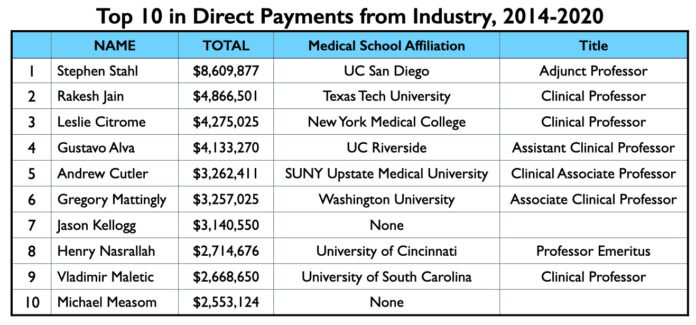
Embora os psiquiatras do clube de um milhão de dólares possam não proporcionar prestígio acadêmico às empresas farmacêuticas, eles fazem isso – como um grupo – fornecendo à indústria uma gama de serviços úteis, escrevendo textos de psicofarmacologia, publicando resenhas de novos medicamentos em revistas, servindo em conselhos editoriais de revistas que publicam resenhas de novos medicamentos, administrando empresas de educação continuada, e assim por diante. E depois há o circuito dos palestrantes: vários psiquiatras do clube de milhões de dólares dão mais de 50 palestras pagas por ano.
Como o observado acima, Stephen Stahl está à frente desta lista, tendo sido pago $8,6 milhões por empresas farmacêuticas de 2014 a 2020, com 80% desse valor para “servir como docente ou como orador em um local que não seja um programa de educação continuada”. Embora Stahl possa ter apenas uma única consulta clínica em uma escola médica (UC San Diego), ele é uma estrela no mundo da psicofarmacologia.
Em 1991, a carreira de Stahl sofreu um tropeço quando o Escritório de Integridade Científica do Departamento de Saúde e Serviços Humanos dos EUA determinou que Stahl, então professor de psiquiatria na Universidade de Stanford, tinha sido o autor principal de dois artigos que eram “seriamente enganosos” e que ele era culpado de plágio em um capítulo de livro que ele tinha escrito. Stahl deixou Stanford para um cargo na UC San Diego e, em muito pouco tempo, este mini-escândalo foi esquecido. Nos últimos 25 anos, ele tem sido indiscutivelmente o psiquiatra mais influente do mundo com relação ao uso de medicamentos psicotrópicos, tal como seu livro didático, Psicofarmacologia Essencial de Stahl, e seu manual clínico, Guia de Prescrição de Psicofarmacologia Essencial, pode ser encontrado regularmente nas estantes daqueles que prescrevem medicamentos psiquiátricos. Em 2000, ele fundou o Neuroscience Education Institute (NEI), uma empresa de educação médica que produz webinars e cursos de educação continuada sobre psicofarmacologia. O NEI também publica a CNS Spectrums, uma revista revisada por pares com Stahl como editor-chefe. À medida que novos medicamentos são testados e recebem aprovação da FDA, ele escreve regularmente artigos sobre eles, muitas vezes enfocando seu mecanismo de ação e publicando artigos em sua própria revista. Como observa a sua biografia no site do Instituto de Educação em Neurociência, ele é um palestrante popular no circuito de palestras:
“Palestras, cursos e preceptorias baseadas em seus livros didáticos o levaram a dezenas de países em 6 continentes para falar a dezenas de milhares de médicos, profissionais da saúde mental e estudantes de todos os níveis. Suas palestras e apresentações científicas foram distribuídas em mais de um milhão de CD-ROMs, programas educacionais na Internet, fitas de vídeo, fitas de áudio e textos programados de estudo doméstico para a educação médica contínua a centenas de milhares de profissionais em muitos idiomas diferentes. Seus cursos e materiais de ensino multimídia premiados são utilizados por professores e estudantes de psicofarmacologia em todo o mundo. O Dr. Stahl também escreve dicas didáticas para profissionais da saúde mental em inúmeras revistas”.
O NEI promete abertamente às empresas farmacêuticas que pode ajudá-las a vender seus medicamentos. Seu Congresso de 2021, programado para novembro, tem apresentações de vários palestrantes favoritos da indústria, e as empresas farmacêuticas são instadas a pagar por exposições que as ajudarão a “se conectar com mais de 2000 profissionais de saúde mental sediados nos EUA, 95% dos quais têm privilégios de prescrição”. As empresas farmacêuticas também podem pagar para “hospedar” simpósios para “educar um público selecionado de prescritores”. Juntos, as exposições e simpósios fornecem às empresas farmacêuticas uma oportunidade de “aumentar o reconhecimento da marca e estimular o interesse dos participantes pelo seu produto”.
Rakesh Jain, um professor clínico de psiquiatria da Texas Tech University School of Medicine, ocupa o segundo lugar na lista dos milhões de dólares. Seu currículo de 41 páginas apresenta uma longa lista de atividades de uso para empresas farmacêuticas: investigador principal em ensaios clínicos (e ocasionalmente autor contribuinte de resultados de pesquisa); consultor para mais de 15 empresas farmacêuticas ao longo dos anos; apresentador regular no circuito CME; revisor para mais de uma dúzia de revistas médicas (a maioria com foco em terapias medicamentosas); numerosas aparições na mídia; e palestrante para dezenas de empresas. As empresas farmacêuticas lhe pagaram 4,867 milhões de dólares de 2014 a 2020, com 67% deste valor por serviços de palestra, 19% por “honorários” e despesas de viagem, e 14% por consultoria. Ele prestou serviços a mais de 30 empresas farmacêuticas durante este período.
O número três na lista de milhões de dólares é Leslie Citrome, Professor Clínico de Psiquiatria e Ciências Comportamentais na Faculdade de Medicina de Nova York em Valhalla, Nova York. Embora não seja bem a estrela que Stahl é no mundo da psicofarmacologia, ele é uma pessoa de grande influência. Atualmente ele é presidente da Sociedade Americana de Psicofarmacologia Clínica. A “revista oficial” da Sociedade é o Journal of Clinical Psychiatry, um local favorito das empresas farmacêuticas para publicarem resultados de ensaios clínicos. A Sociedade é também um provedor de cursos de educação médica contínua. Citrome realiza consultas com empresas farmacêuticas enquanto elas testam e comercializam seus novos medicamentos, e uma vez que um medicamento é aprovado, ele escreve regularmente revisões que se expandem, de uma forma ou de outra, sobre as evidências de sua segurança e eficácia. Ele faz parte da diretoria de 11 revistas médicas e, como diz seu perfil no Linkedin, ele tem “ministrado palestras extensivas em todos os EUA, Canadá, Europa e Ásia”.
Empresas farmacêuticas pagaram a Citrome US$ 4,275 milhões por seus serviços de 2014 a 2020, com 55% deste total para palestras e palestras, e outros 25% para serviços de consultoria. Os 20% restantes foram para honorários, subvenções, presentes e despesas de viagem. Doze empresas farmacêuticas lhe pagaram mais de $100.000 durante este período de sete anos.
Outro caminho para entrar na indústria de serviços de consultoria é servir como investigador principal em ensaios clínicos, ou, melhor ainda, administrar uma empresa com fins lucrativos que realiza ensaios clínicos financiados pela indústria. Jelena Kunovac é uma das várias com esta experiência em seu currículo. Em 2012, ela fundou a Altea Research em Las Vegas e, como diz seu website, a Altea “faz parcerias com grandes patrocinadores farmacêuticos para conduzir pesquisas clínicas para novos medicamentos e tratamentos, principalmente na área de psiquiatria”. Desde 2014, ela recebeu US$ 1,276 milhões por sua presença regular no circuito de palestrantes. A maior parte deste trabalho veio de três empresas: Sunovion (Latuda); Alkermes (Aristada); e Otsuka (Rexulti e Abilify Maintena).
Prakash Masand, 35º na lista, há muito prosperou como fornecedor de serviços de educação médica contínua. Professor adjunto da Duke-National University of Singapore Medical School, ele fundou a psychCME. Depois que essa empresa foi adquirida pela United Health Group em 2006, ele fundou uma segunda empresa CME, Global Medical Education, que foi adquirida pela Clinical Care Options em 2020. As empresas farmacêuticas fornecem apoio às empresas CME, que é usada para pagar palestrantes em eventos CME, mas como as empresas “independentemente” selecionam os palestrantes, estes pagamentos não aparecem no banco de dados de Pagamentos Abertos. Tais eventos, é claro, são outra forma de as empresas farmacêuticas criarem um mercado para seus novos medicamentos e finalmente canalizarem dinheiro para os palestrantes, e isto fez com que Masand, como proprietária das empresas CME, tenha um valor considerável para a indústria.
A nível pessoal, Masand recebeu 1,448 milhões de dólares de 2014 a 2020, com 84% deste financiamento para falar e despesas de viagem relacionadas. Grande parte deste pagamento veio da Allergan por promover o Vraylar, um antipsicótico.
Outros na lista construíram carreiras como palestrantes sem nenhuma filiação acadêmica. Por exemplo, Rebecca Roma, psiquiatra na região de Pittsburgh, ganhou 2,446 milhões de dólares de 2014 a 2020, com 90% para falar e as despesas de viagem relacionadas. Otsuka, Janssen, e Alkermes foram seus três principais clientes. Em uma linha semelhante, Christopher Bojrab, que é o psiquiatra da equipe da Indiana Pacers, ganhou US$ 1 milhão durante os sete anos, servindo como orador para cerca de meia dúzia de empresas. Sua biografia conta como ele dá mais de 100 palestras a cada ano.
Uma vez que os psiquiatras passam para a primeira linha de palestrantes, eles podem esperar permanecer lá, particularmente se desenvolverem laços com várias empresas. A maioria das pessoas do clube do milhão de dólares gera renda estável de seis dígitos ano após ano (embora tais pagamentos tenham caído notavelmente em 2020 durante a pandemia, já que as conferências e eventos presenciais desapareceram).
Em 2013, a ProPublica publicou um artigo detalhando como 22 médicos, com base em divulgações das 15 maiores empresas farmacêuticas, haviam ganho mais de US$ 500.000 de 2009 a 2012 por suas atividades de palestras e consultoria. Doze dos 22 eram psiquiatras, e todos os 12 aparecem de forma proeminente no banco de dados de Pagamentos Abertos. Cinco das 12 estão entre as 10 primeiras na lista de milhões de dólares da psiquiatria, e outras cinco estão no clube. Os dois restantes acabaram de não acertar esta marca.
O psiquiatra acadêmico mais proeminente que aparece no clube de um milhão de dólares é Christoph Correll. Professor de psiquiatria na Escola de Medicina Donald e Barbara Zucker em Hofstra/Northwell, ele é bem conhecido por suas pesquisas sobre antipsicóticos. Outro acadêmico de destaque na lista é Rifaat El-Mallakh, professor de psiquiatria na Faculdade de Medicina da Universidade de Louisville, conhecido por sua experiência em transtornos do humor. Sua aparição na lista é um tanto surpreendente dado que ele é autor de vários artigos sobre como os antidepressivos podem causar disforia tardia e, ainda mais amplamente, sobre como os medicamentos psiquiátricos podem induzir uma “tolerância oposta” que leva a uma “resistência ao tratamento” a longo prazo e a doenças crônicas.
Os pagamentos a psiquiatras acadêmicos que atuaram como autores de artigos relacionados aos sete novos medicamentos são discutidos na Parte Dois. Aqui está uma amostra dos pagamentos a outros psiquiatras proeminentes que prestaram serviços de consultoria ou de palestras à indústria de 2014 a 2020: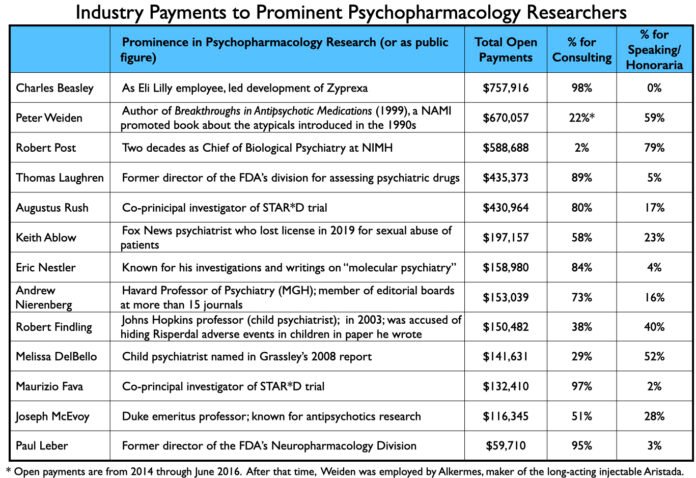
A Fachada Desapareceu
Do ponto de vista da saúde pública, os testes clínicos de novas drogas devem fornecer evidências de que uma droga é segura e eficaz e, portanto, pode proporcionar um “benefício” médico para a sociedade. Os resultados publicados desses testes servem então como descobertas que são promovidas aos médicos prescritores através de livros didáticos, cursos de CME e conferências que “informam” a comunidade médica sobre o que a ciência tem revelado sobre um novo medicamento.
Para que o público confie nessa ciência, ele precisa acreditar que ela está livre de influência comercial. Os testes devem ser conduzidos por investigadores independentes, e as subseqüentes revisões do medicamento e as conferências devem ser livres de manchas da indústria também. Há mais de uma década, o público se desencantou quando soube que sob uma fachada de integridade científica, com relatórios de resultados de ensaios clínicos listando psiquiatras acadêmicos como autores, as empresas farmacêuticas estavam agora projetando os ensaios, analisando os resultados, e artigos escritos por autores-fantasmas. Os autores nomeados estavam emprestando seu prestígio acadêmico a este processo, como se ainda fossem eles que controlavam a pesquisa.
Essa fachada agora desapareceu. Nesta era de divulgação, o controle das empresas sobre a pesquisa e a falta de testes independentes dos medicamentos são agora bastante visíveis.
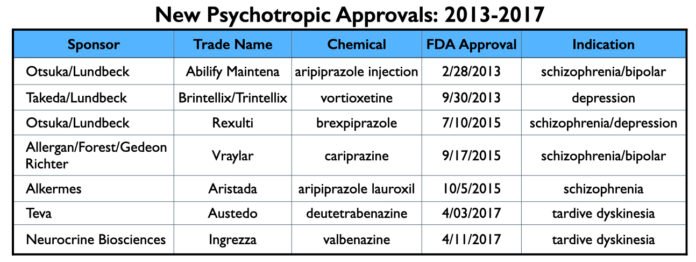
De 2013 a 2017, a FDA aprovou duas formulações de longa ação de aripiprazol, dois antipsicóticos (testados para múltiplas indicações), um antidepressivo e dois medicamentos para a discinesia tardia. O Mad in America publicou 22 relatórios de seus resultados de ensaios clínicos, e embora esta amostra não seja exaustiva de todos esses relatórios, ela é representativa.
Cada artigo listou pelo menos dois funcionários da empresa como autores. Enquanto normalmente um não-empregado foi listado como o autor principal, quatro artigos sobre cariprazina listaram um funcionário como autor principal. Mais notável, dois proprietários da patente da cariprazina foram listados como autores em cinco dos artigos revisados pelo MIA.
No total, havia 187 autores nomeados nos 22 relatórios. Cento e dezenove eram funcionários. Quanto aos 68 não-empregados nomeados como autores, houve apenas cinco casos em que um autor não tinha um vínculo financeiro com o patrocinador, seja durante o estudo (conforme divulgado no relatório publicado), ou em algum momento de 2014-2020 (conforme divulgado no banco de dados de Pagamentos Abertos).
Como havia um número de autores nomeados em dois ou mais relatórios, o número de indivíduos autores de relatórios era muito inferior a 187.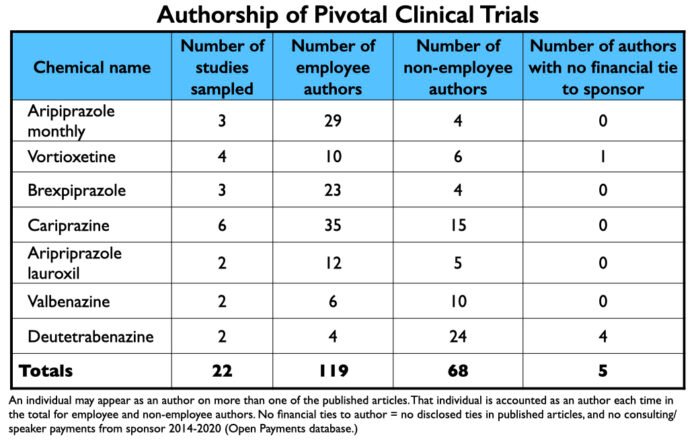
Muitos dos ensaios foram conduzidos no exterior, e dado que a maioria dos autores eram funcionários da empresa, havia um número surpreendentemente pequeno de psiquiatras dos EUA na lista de autores. Dezessete psiquiatras americanos e oito neurologistas americanos foram nomeados como autores nos 22 relatórios (que foram listados um total de 49 vezes.) Vinte e três dos 25 receberam pagamentos das empresas farmacêuticas que patrocinaram os ensaios, seja durante o ensaio ou após a aprovação dos medicamentos pela FDA.
Como grupo, os 25 médicos dos EUA receberam 4,8 milhões de dólares por seus serviços de consultoria/falante a empresas farmacêuticas cujo medicamento eles “testaram”. Entretanto, muitos dos 25 prestaram serviços de consultoria e/ou palestras a uma multidão de outras empresas farmacêuticas, prova de como eles eram um grupo para a indústria, com ganhos coletivos de $17,5 milhões de dólares de 2014-2020.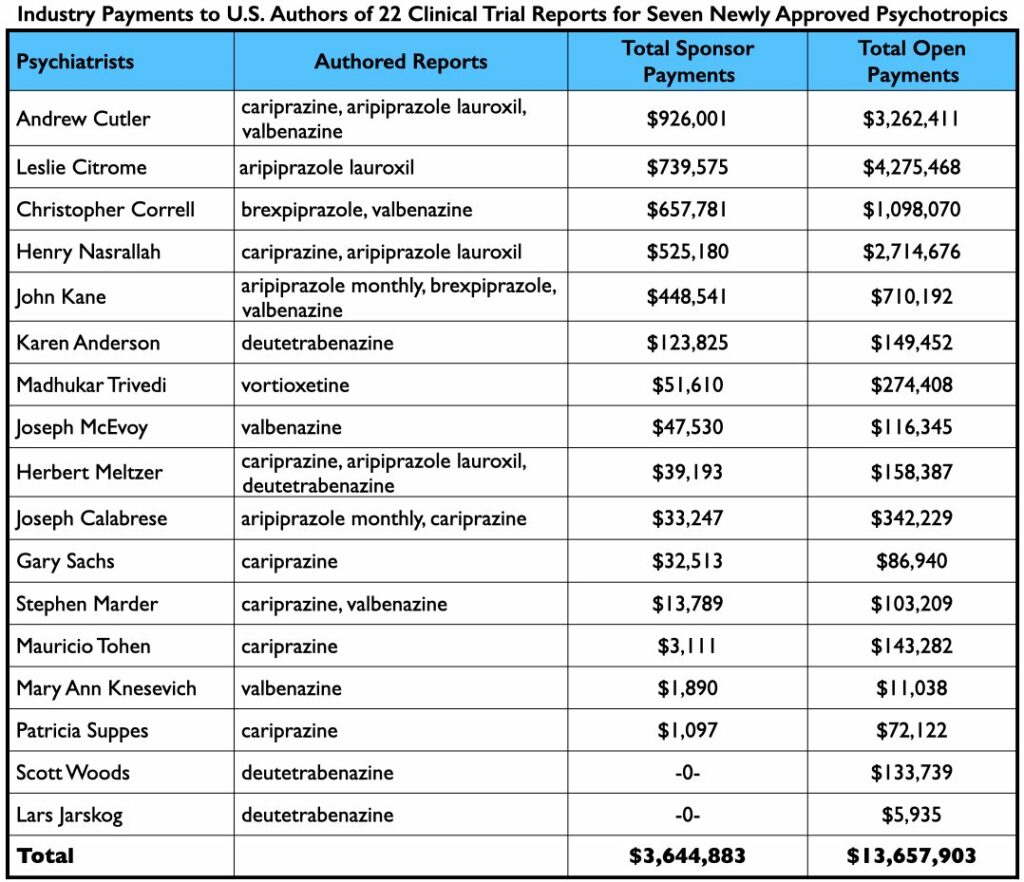
O fato de a fachada de uma avaliação independente ter desaparecido pode ser visto como uma melhoria: O aspecto comercial está em aberto. No entanto, a pretensão de que os ensaios são um empreendimento científico permanece. E embora isso possa parecer contra-intuitivo, os requisitos de divulgação ajudam a criar essa pretensão.
Nos relatórios publicados, as empresas listam seus funcionários como autores e os não-empregados revelam seus laços financeiros com o patrocinador e com outras empresas farmacêuticas. As listas de divulgação dos não-empregados podem continuar, e muitas vezes aparecem em letras pequenas que são difíceis de ler. Mas esta “transparência” é apresentada como prova do cumprimento das Leis da Luz Solar e, portanto, parte de um processo científico aceito. Os relatórios publicados então relatam resultados “estatisticamente significativos” de “ensaios duplo-cegos, controlados por placebo”, que é uma linguagem que informa aos leitores que tais resultados surgiram de uma avaliação metodologicamente correta do medicamento.
Juntos, as revelações e a linguagem científica nos relatórios publicados ajudam a ocultar o óbvio, que é que os testes de drogas psiquiátricas – e o relato dos resultados – acontecem completamente dentro de um contexto comercial. As empresas farmacêuticas querem ver seus medicamentos experimentais declarados “seguros e eficazes”, e contratam consultores com a expectativa de que os ajudem a atingir este fim. A influência do dinheiro flui toda para atingir esse objetivo.
Além disso, o pagamento aos autores dos resultados dos ensaios é simplesmente o primeiro passo de um processo de desenvolvimento de medicamentos que é lubrificado pelo dinheiro farmacêutico do início ao fim.
As Revistas de Psicofarmacologia
Poucos resultados de ensaios clínicos envolvendo medicamentos psiquiátricos são publicados em revistas médicas de prestígio. Em vez disso, eles são publicados principalmente em revistas com foco na “psicofarmacologia”. Tais artigos falam regularmente de drogas que são “seguras e eficazes”, com discussões sobre como as novas drogas podem proporcionar um benefício terapêutico de algum tipo em relação às drogas existentes no mercado.
Um ponto de chegada comum para tais relatórios é o Journal of Clinical Psychiatry. Embora possa não ser uma revista de prestígio, tem um grande impacto: a revista afirma que é a “revista de psiquiatria clínica” mais citada do mundo, com quase 22.000 citações anuais. Como foi observado acima, é a revista oficial da Sociedade Americana de Psicofarmacologia Clínica (ASCP).
Sete dos 22 relatórios descritos acima foram publicados nesta revista. Além disso, uma vez publicados os resultados iniciais dos ensaios, outros “especialistas” em psicofarmacologia, tais como Leslie Citrome e Stephen Stahl, publicam artigos de revisão que descrevem o mecanismo de ação dos medicamentos, resultados dos ensaios clínicos e como os novos medicamentos se comparam a medicamentos similares já existentes no mercado. Muitas vezes, estes artigos de revisão sugerem que o novo medicamento tem uma eficácia ligeiramente maior ou menos efeitos colaterais, uma sugestão que pode levar os prescritores a experimentar o medicamento. O Journal of Clinical Psychiatry também serve como casa para estes artigos.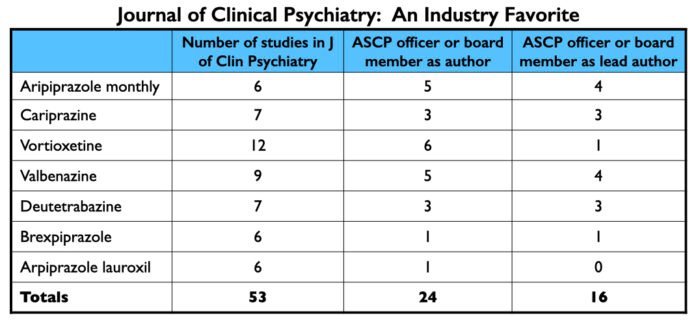
No total, o Journal of Clinical Psychiatry publicou pelo menos 53 artigos sobre os sete medicamentos aprovados de 2013 a 2017. Vinte e quatro tinham um membro oficial ou do conselho da ASCP listado como autor; um membro do conselho da ASCP foi o autor principal em 16 dos 53. Quase todos os dirigentes e membros do conselho da ASCP têm vínculos financeiros com a indústria.
Os três dirigentes da ASCP, liderados por Leslie Citrome, receberam coletivamente US$ 4,62 milhões das empresas farmacêuticas para atuar como consultores ou palestrantes de 2014 a 2020. Os 14 membros do conselho da ACSP receberam $3,37 milhões para estes fins durante este período.
Em suma, durante o período em que o Journal of Clinical Psychiatry publicou pelo menos 53 relatórios sobre os sete novos medicamentos, os diretores e membros do conselho da ASCP foram pagos $8 milhões pelas empresas farmacêuticas, com a maior parte deste financiamento vindo dos fabricantes dos novos medicamentos.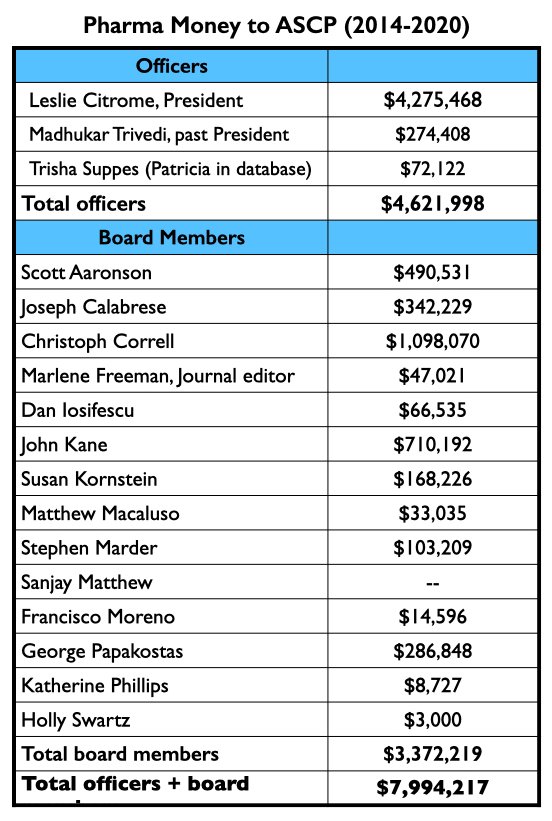
O CNS Spectrums é outro periódico amigo da indústria. Como observado acima, Stephen Stahl é seu editor-chefe, e a revista é publicada pela empresa de educação médica por ele fundada, Neuroscience Education Institute. CNS Spectrums publicou pelo menos 71 artigos sobre os sete novos medicamentos, com Stahl e Citrome cada um autor de 10 deles.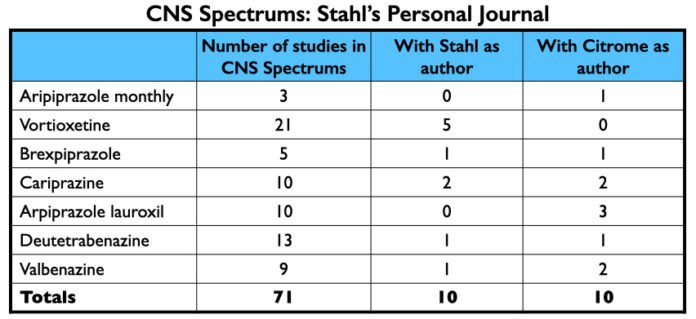
Juntos, Stahl e Citrome foram pagos $12,9 milhões por empresas farmacêuticas de 2014 a 2020. A maior parte deste financiamento foi para dar palestras: $6,9 milhões para Stahl; $2,4 milhões para o Citrome.
A árvore do dinheiro CME
O banco de dados de Pagamentos Abertos fornece um registro de $340 milhões em pagamentos diretos de empresas farmacêuticas a psiquiatras dos EUA de 2014 a 2020. Além disso, as empresas farmacêuticas fornecem financiamento às empresas de educação médica contínua para a realização de cursos e eventos. Este financiamento, enquanto flui para palestrantes, não está incluído no banco de dados de Pagamentos Abertos porque a empresa CME, não a empresa farmacêutica, seleciona os palestrantes. Portanto, não é um pagamento direto aos palestrantes, mas esses palestrantes são freqüentemente os mesmos psiquiatras que estão sendo pagos pela empresa farmacêutica para servir como seus consultores e palestrantes. Os críticos desta prática de não-divulgação a compararam a “lavagem de dinheiro“.
De 2014 a 2020, os pagamentos da indústria às empresas CME totalizaram US$ 5,1 bilhões. Uma estimativa aproximada, com base nos dados disponíveis, é que isto teria proporcionado um adicional de US$ 100 milhões em honorários de oradores para psiquiatras americanos durante este período.
Este é o “grande quadro” da indústria da psicofarmacologia. A influência de todo dinheiro flui em uma direção, e a cada passo – a concepção dos ensaios clínicos, a publicação dos resultados e a subseqüente divulgação desses resultados – o dinheiro é gasto para contar uma história que resultará em sucesso comercial. Não há um único centavo gasto para servir ao bem público, o que seria um processo concebido para avaliar criticamente os efeitos gerais de um medicamento e comunicar essas descobertas, mesmo que negativas, à comunidade médica e ao público.
Segunda parte
Estudos de Caso de Sete Novas Drogas
Se o financiamento da indústria de psiquiatras não comprometesse os testes de drogas de investigação e a subseqüente disseminação dos resultados, então talvez pudesse ser visto como um processo comercial que, no entanto, repousava sobre uma ciência decente. As sete novas drogas psiquiátricas aprovadas de 2013 a 2017 fornecem estudos de caso para avaliar se isso é verdade.
Aqui estão alguns elementos comuns a serem considerados ao criticar os méritos dos relatórios de estudos clínicos sobre medicamentos psiquiátricos:
- Os critérios de inclusão, ou o desenho do protocolo, selecionam para um subgrupo de pacientes que poderiam ser bons respondedores ao medicamento em estudo?
- Os critérios de inclusão/exclusão selecionam para um subgrupo de pacientes que se poderia esperar que não respondessem bem quando mudado para placebo?
- Existe um verdadeiro grupo placebo no estudo, ou o grupo placebo é composto de pacientes crônicos que foram retirados dos medicamentos psiquiátricos que tomaram?
- Foram comparadas doses múltiplas do medicamento em estudo com uma única dose de placebo, o que dá ao medicamento em estudo “múltiplas” chances de obter um benefício estatisticamente significativo?
- O achado estatisticamente significativo de “eficácia”, que indica uma diferença pontual na redução dos sintomas entre o tratamento do medicamento e o placebo, é de significância clínica? Os pesquisadores chamam este padrão de “diferença mínima clinicamente importante”, e ele requer regularmente uma diferença de pontos maior do que a significância estatística.
- A conclusão no resumo é consistente com os dados apresentados no artigo?
A composição do grupo placebo, é claro, é de particular importância. Se for um grupo com medicamentos retirados, estes pacientes podem experimentar uma variedade de dificuldades psiquiátricas e físicas que pioram seus resultados sobre medidas de eficácia e levam a uma incidência muito maior de efeitos adversos do que seria o caso no curso normal da “doença”.
Todas estas são questões que podem ser investigadas através da “desconstrução” dos relatórios publicados. Se essas maquinações existirem, elas devem ser visíveis nos periódicos científicos. O que permanece desconhecido de tal revisão é se uma empresa farmacêutica e seus autores fizeram a apresentação dos dados ou eventos adversos ocultos, e quantos julgamentos fracassados nunca foram publicados. O que se segue, com uma exceção, é um olhar sobre os artigos publicados que informam resultados positivos para os medicamentos.
Abilify Maintena (aripiprazole injetável)
Otsuka e Lundbeck trouxeram Abilify Maintena, uma formulação de longa ação do aripiprazol, para o mercado em 2013 como tratamento para esquizofrenia e em 2017 como tratamento de manutenção para bipolar 1.
Em relatórios de três estudos fundamentais para estas duas condições, 18 dos 21 autores eram funcionários da empresa. Dois dos três não-empregados eram psiquiatras americanos, John Kane e Joseph Calabrese. Kane foi o autor principal em dois estudos sobre esquizofrenia, enquanto Calabrese foi o autor principal em um estudo bipolar. Ambos são membros da diretoria da Sociedade Americana de Psicofarmacologia Clínica.
Os resultados publicados
No ensaio de manutenção para esquizofrenia, os pesquisadores inscreveram 843 pacientes esquizofrênicos que tinham um “histórico de exacerbação ou recaída dos sintomas quando não recebiam tratamento antipsicótico”. Todos os inscritos na pesquisa foram então “titulados de forma cruzada” do antipsicótico em que tinham estado com o aripiprazole oral. Aqueles que se estabilizaram neste medicamento por quatro semanas foram transicionados para o aripiprazol injetável uma vez por mês, e aqueles que se estabilizaram bem no injetável por três meses foram randomizados em um ensaio duplo-cego, com um grupo mantido no injetável e o outro recebendo uma injeção de placebo.
Com este projeto, 403 dos 843 inscritos iniciais chegaram à randomização. Apenas 10% do grupo mantido com drogas recaíram durante as semanas e meses seguintes, contra 40% do grupo placebo. “A nova formulação do aripiprazol IM-depot é eficaz para prevenir recaídas na esquizofrenia e representa uma opção de tratamento alternativo com um perfil de segurança semelhante ao do aripiprazol oral”, concluiu Kane e os funcionários da empresa autores do relatório. O artigo, que foi publicado no Journal of Clinical Psychiatry, foi intitulado “Aripiprazole intramuscular depot como tratamento de manutenção em pacientes com esquizofrenia: um estudo de 52 semanas, multicêntrico, randomizado, duplo-cego, controlado por placebo”.
O estudo de manutenção em pacientes bipolares 1 tinha um desenho semelhante. Os pacientes que estavam passando por um episódio maníaco foram primeiro estabilizados no aripiprazol oral e depois no injetável por vários meses. Este seleto grupo de boas respostas ao Abilify Maintena foi então randomizado para continuar o tratamento com o injetável ou placebo. Vinte e sete por cento dos pacientes medicados experimentaram um episódio de humor durante o acompanhamento de 52 semanas em comparação com 51% do grupo de placebo. “Estas descobertas”, escreveu Joseph Calabrese e os funcionários da empresa, “apoiam o uso de aripiprazole uma vez por mês (AOM 400) para o tratamento de manutenção da BP-1”.
A crítica
Os viéses por projeto nestes estudos são evidentes. No estudo da esquizofrenia, os critérios de inclusão selecionados para os pacientes que tinham um histórico de mau desempenho ao interromper a medicação antipsicótica, foi o que ajudou a selecionar para os pacientes que poderiam ser esperados a piorar quando aleatorizados para placebo. Em seguida, o protocolo, através de sua extensa fase de estabilização, foi selecionado para um grupo de bons respondentes ao Abilify Maintena (403 de 843 inscritos iniciais). Na aleatorização, este grupo seleto teve uma pontuação média de 54,5 na Escala de Sintomas Positivos e Negativos (PANSS), significando que eles estavam apenas “moderadamente doentes”. Dado o desenho deste estudo, aqueles randomizados para tratamento continuado com Abilify Maintena poderiam esperar permanecer estáveis, que foi o que ocorreu. Suas pontuações PANSS permaneceram as mesmas. Entretanto, aqueles que mudaram para placebo começaram a piorar dentro de duas semanas, com seus escores PANSS subindo rapidamente até meados dos anos 60, quando muitos foram classificados como próximos de “recaídas” e descontinuados do estudo. Sessenta e dois por cento no grupo de placebo sofreram “tratamento emergente” de eventos adversos, tais como acatisia, ansiedade, dor de cabeça e tremores, todos eles sintomas conhecidos de abstinência.
No entanto, mesmo dado este desenho tendencioso, a diferença de 12 pontos na pontuação média do PANSS entre os dois grupos no final do estudo, 66 a 54 não subiu ao nível de proporcionar um benefício clinicamente significativo. O PANSS é uma escala de 210 pontos, e os pesquisadores determinaram que é necessário haver pelo menos uma diferença de 15 pontos entre medicamento e placebo para que o “benefício” do tratamento seja de importância clínica.
Além disso, a partir do momento da inscrição inicial, apenas uma pequena minoria de pacientes se estabilizou no Abilify Maintena e permaneceu estável durante o ensaio em dupla ocultação. Embora a matemática seja um pouco complicada, a taxa de fracasso dos pacientes tratados com Abilify Maintena- quer na fase de estabilização ou depois de ter sido aleatorizado para o braço do medicamento do ensaio- foi de 72%. Os pesquisadores também interromperam o ensaio cedo, de tal forma que havia apenas 23 pacientes no estudo que haviam permanecido estáveis com Abilify Maintena por 52 semanas, uma taxa documentada de “estabilização” a longo prazo de 3%. No entanto, o título do artigo publicado contava como este tratamento tinha provado ser um “tratamento de manutenção” eficaz durante um ano inteiro.
Quanto a eventos adversos, dois pacientes do braço Abilify Maintena morreram, incluindo um de um evento coronário, mas os investigadores concluíram que essas mortes não estavam “relacionadas” com o tratamento.
Os números são apenas ligeiramente melhores para o ensaio bipolar. Havia 731 pacientes inscritos no estudo, e deste grupo, 266 estabilizaram suficientemente bem em Abilify Maintena para serem randomizados no estudo. Dos 133 randomizados para o braço do medicamento, apenas 64 permaneceram bem e no ensaio até o final (52 semanas). Havia 598 pacientes que tiveram a chance de se estabilizar no medicamento e ser mantidos no mesmo após a randomização (731 menos 133 randomizados para placebo); a taxa de estabilização documentada a um ano para este grupo consistentemente medicado foi de 11% (64/598).
A árvore do dinheiro
Kane publicou um segundo estudo que constatou que Abilify Maintena era um tratamento seguro e eficaz para exacerbações agudas da esquizofrenia. Uma vez publicados os resultados dos ensaios centrais, outros publicaram revisões dos dados de Abilify Maintena, ajudando a fazer um caso para seu uso. Leslie Citrome escreveu três artigos discutindo o Abilify Maintena, um dos quais contou como ele havia desenvolvido um “modelo hipotético” para compará-lo com o Invega, um injetável de longa duração já existente no mercado, e nesta comparação, o Abilify Maintena produziu melhores resultados clínicos e reduziu as taxas de re-hospitalização, o que produziria economias substanciais para a sociedade, embora o custo de prescrição do Abilify Maintena fosse muito mais alto do que o do Invega.
Aqui está o dinheiro da indústria que fluiu para a Kane, Calabrese e Citrome por seus serviços de consultoria e ou de oradores especificamente relacionados ao Abilify Maintena de 2013 a 2018 (banco de dados ProPublica), e seus pagamentos totais de Lundbeck e Otsuka- os dois comerciantes do Abilify Maintena-de 2014 a 2020 (banco de dados de pagamentos abertos).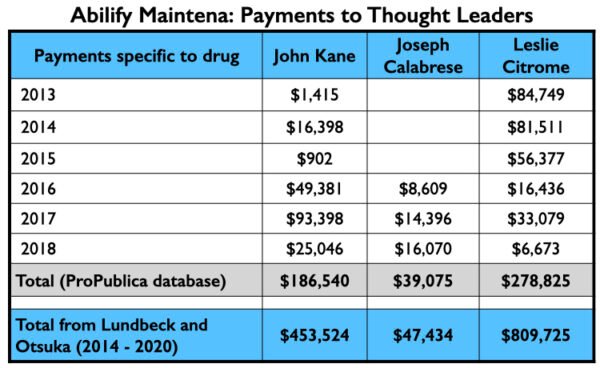
Uma vez que Abilify Maintena foi aprovada, Otsuka e Lundbeck enviaram seus palestrantes ao mundo. Dois de seus quatro palestrantes mais bem pagos, Rebecca Roma e Charles Tuan-S Nguyen, apareceram regularmente na Psych U, que é como Otsuka e Lundbeck marcaram seus “serviços educacionais” online. O terceiro, Matthew Brams, ajudou a lançar o Abilify Maintena para comitês que aprovam pagamentos da Medicaid por drogas. O quarto, Rifaat El-Mallakh, forneceu a Otsuka e Lundbeck um palestrante que poderia emprestar prestígio acadêmico a seus esforços promocionais.
Aqui está o dinheiro que eles ganharam para promover o Abilify Maintena de 2013 a 2018 (banco de dados Pro Publica), e o total que ganharam de Lundbeck e Otsuka de 2014 a 2020. (Banco de dados de Pagamentos Abertos).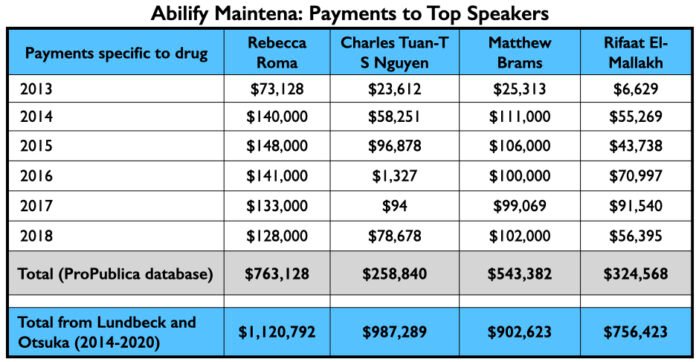
Este processo em três etapas – publicação dos resultados dos ensaios, revisões adicionais dos resultados dos ensaios e, em seguida, a promoção do medicamento através de palestras, conferências e apresentações on-line – transformou o Abilify Maintena em um sucesso comercial, com vendas somente para a Medicare e Medicaid totalizando US$ 3 bilhões de 2014 a 2019. As vendas para seguradoras privadas de saúde e vendas fora dos EUA não estão incluídas neste total.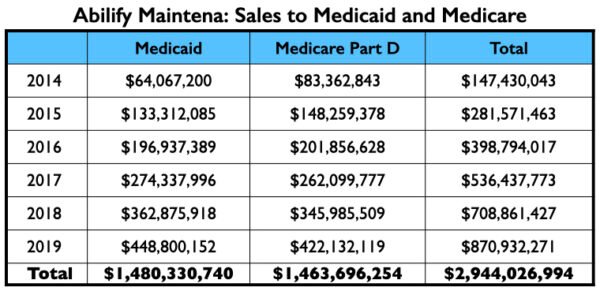
Trintellix/vortioxetina
Takeda e Lundbeck obtiveram a aprovação da FDA para a vortioxetina como tratamento para depressão em 2013, comercializando-a como Brintellix. Em 2016, eles mudaram o nome comercial para Trintellix.
Em quatro relatórios de ensaios clínicos essenciais, oito dos autores eram funcionários da Takeda ou da Lundbeck. Dos cinco autores não-empregados, quatro revelaram que haviam sido pagos por pelo menos um dos patrocinadores por serviços de consultoria e/ou oradores. O único psiquiatra dos EUA nomeado como autor nos quatro relatórios foi Madhukar Trivedi, que foi consultor de ambos os patrocinadores.
Os resultados publicados
Três testes avaliaram várias doses do medicamento versus placebo por até oito semanas. Juntos, os ensaios relataram cinco comparações com placebo que foram positivas para a vortioxetina (a 5 mg, 10 mg, 15 mg e 20 mg.), e uma comparação onde ela não mostrou eficácia (a 10 mg). Um quarto estudo concluiu que o medicamento era eficaz para reduzir o risco de recidiva.
Cinco conhecidos psiquiatras americanos, liderados por Alan Schatzberg, juntamente com um psiquiatra canadense, publicaram posteriormente uma “visão geral da vortioxetina” no Journal of Clinical Psychiatry. Eles escreveram o seguinte:
- Que este “novo antidepressivo” foi entendido para “aumentar os níveis de serotonina, norepinefrina, dopamina, acetilcolina e histamina em áreas específicas do cérebro”, o que, pelo menos em teoria, poderia proporcionar “resultados potencialmente únicos e benéficos em pacientes tratados com o agente”.
- Que tinha provado ser eficaz no tratamento da depressão “em seis ensaios clínicos”.
- Que a sua “atividade farmacológica multimodal pode transmitir benefícios na função cognitiva”.
- Que o seu “perfil de tolerabilidade favorável pode ter vantagens significativas com relação ao ganho de peso e baixa disfunção sexual que podem beneficiar os pacientes”.
Leslie Citrome publicou várias revisões relacionadas à vortioxetina e concluiu que, em comparação com outros antidepressivos já existentes no mercado, era igualmente eficaz, mas possivelmente mais tolerável e com menos efeitos colaterais.
A crítica
À primeira vista, os três testes de curto prazo falam de um medicamento eficaz. Embora várias doses de vortioxetina tenham sido comparadas com uma dose de placebo nos ensaios, a vortioxetina produziu um benefício estatisticamente significativo em cinco das seis comparações, e a diferença nessas cinco comparações variou de 3,6 pontos a 7,1 pontos na Escala de Classificação de Depressão Montgomery-Asberg (MADRS), uma separação medicamento-placebo entendida como proporcionando um benefício clinicamente importante.
Há o problema usual de que o grupo placebo em cada um destes estudos foi composto de pacientes que foram retirados da medicação. Houve também uma característica de desenho nos estudos realizados fora dos Estados Unidos – e possivelmente também nos ensaios nos EUA – que fala de um esforço deliberado para minimizar os eventos adversos com a vortioxetina. Em vez de fazer com que os investigadores questionassem os pacientes sobre efeitos colaterais específicos conhecidos como associados a antidepressivos (como disfunção sexual), o protocolo dizia aos investigadores para simplesmente perguntarem aos pacientes “Como você se sente?” É de se esperar que a auto-descrição feita pelos pacientes a respeito das reações adversas produza uma contagem muito reduzida de eventos adversos, o que, neste caso, levou à conclusão de que este medicamento era menos provável de causar disfunção sexual do que outros antidepressivos já existentes no mercado.
Mas a eficácia nos ensaios publicados permanece em questão. Entretanto, o Institute for Safe Medication Practices, em uma revisão posterior dos dados submetidos à FDA, constatou que houve 10 ensaios de vortioxetina, ao invés dos seis citados por Schatzberg. Em quatro dos dez, descobriu-se que o medicamento não trazia nenhum benefício sobre o placebo – os patrocinadores tinham se concentrado em publicar os resultados positivos e em ocultar os negativos.
Entre os cinco estudos realizados em pacientes norte-americanos, três não encontraram nenhum benefício sobre o medicamento, e nos outros dois, nenhum benefício sobre o medicamento foi demonstrado com a dose inicial de 10 mg ou 15 mg. Assim, em cinco ensaios nos EUA que compararam 10 ou mais doses de vortioxetina ao placebo, o medicamento pode ter proporcionado um benefício estatisticamente significativo sobre o placebo apenas duas a quatro vezes. A alegação de eficácia, concluiu o Institute for Safe Medication Practices, “dependia muito de ensaios estrangeiros”.
O Instituto também descobriu que uma vez que a vortioxetina estava no mercado, eventos adversos relatados à FDA falavam de um medicamento problemático. Em um período de 12 meses que terminou em 30 de setembro de 2017, houve 45 mortes associadas ao uso da vortioxetina, mudanças adversas de comportamento (suicídio, automutilação, hostilidade e agressão), numerosos relatos de disfunção sexual e o surgimento de distúrbios alimentares.
Do mesmo modo, o Patient Drug News relatou uma longa lista de efeitos colaterais associados à vortioxetina e concluiu que a droga proporcionava “poucos benefícios” e que tinha “riscos significativos”. Enquanto isso, a FDA informou Lundbeck e Takeda que não podiam afirmar que seu medicamento produzia benefícios cognitivos, uma vez que os dados não suportavam tal afirmação.
A árvore do dinheiro
Com seus vários relatórios publicados, Trivedi, Citrome e o grupo de Schatzberg tinham servido como “líderes de pensamento” dos EUA, pronunciando a vortioxetina como segura e eficaz, com possíveis vantagens sobre os antidepressivos existentes. Aqui está o que eles foram pagos pela Takeda e Lundbeck por seus serviços de consultoria/palestras de 2013 a 2018 relacionados à vortioxetina (banco de dados ProPublica), e a quantia total que receberam da Takeda e Lundbeck de 2014 a 2020 (banco de dados de pagamentos abertos):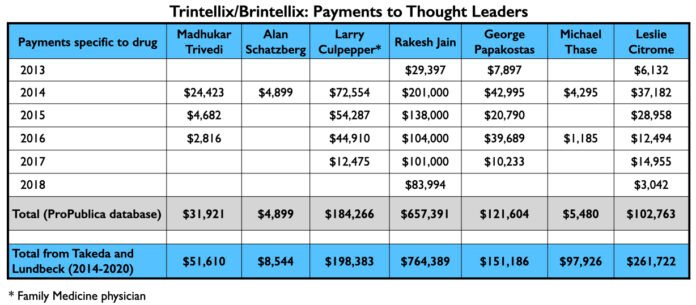
Rakesh Jain, que foi um dos autores do trabalho de Schatzberg, também aparece em uma lista dos quatro principais palestrantes pagos pela Takeda. Aqui está o fluxo de dinheiro que foi para outros três por promover a vortioxetina de 2013 a 2018, e o total que receberam da Takeda e Lundbeck de 2014 a 2020.
Embora este antidepressivo possa não ter mostrado muita eficácia em ensaios clínicos, ele ainda encontrou sucesso no mercado. A Medicaid e a Medicare pagaram mais de US$ 1,25 bilhões aos fabricantes da Trintellix/Brintellix de 2014 a 2019, com as vendas aumentando a cada ano enquanto Stahl e os outros palestrantes faziam suas rodadas.
Rexulti/Brexpiprazole
Otsuka e Lundbeck, que se uniram para trazer a Abilify Maintena ao mercado, também desenvolveram em conjunto a brexpiprazole. A FDA o aprovou em 2015 como tratamento para a esquizofrenia e como tratamento adjunto para a depressão, com as duas empresas comercializando-o como Rexulti.
Em três relatórios de estudos cruciais sobre brexpiprazole para esquizofrenia, 10 dos 12 autores eram funcionários da empresa. Os dois não-empregados eram os psiquiatras americanos Christoph Correll e John Kane.
Os resultados publicados
Os estudos da fase III foram realizados em uma população de pacientes com esquizofrenia crônica que apresentavam uma exacerbação dos sintomas, quase todos os quais estavam em uso de antipsicóticos antes do estudo. Após serem retirados de qualquer antipsicótico que estivessem tomando, os pacientes foram randomizados para uma das quatro doses de brexpiprazole (.25 mg, 1 mg, 2 mg, ou 4 mg) ou para placebo.
Em uma análise conjunta dos estudos da fase III, ao final de seis semanas, os grupos de 2 mg. e 4 mg. tiveram diminuições “estatisticamente significativas” maiores em seus escores de PANSS do que aqueles tratados com placebo. Kane, Correll e os funcionários da empresa concluíram que esta “meta-análise dos estudos centrais indica que brexpiprazole 2 mg e 4 mg são eficazes no tratamento da esquizofrenia aguda”.
A crítica
Há três ensaios clínicos com brexpiprazole para revisão: um estudo fase II e dois estudos separados fase III (sem análise conjunta). Em todos os três estudos, há o habitual grupo de retirada do medicamento mascarado como um grupo placebo, e múltiplas doses do medicamento em estudo são comparadas com uma dose de placebo. Os pacientes do primeiro episódio não eram elegíveis para o estudo (o que assegurava que nenhum paciente ingênuo estaria na coorte de placebo).
O principal resultado foi a redução dos sintomas no PANSS. Mesmo com o desenho tendencioso, nem uma única dose de brexpiprazole – seja no estudo fase II ou nos estudos fase III – chegou perto de fornecer a diferença de 15 pontos que é entendida como proporcionando um benefício “mínimo clinicamente importante”.
Mesmo em termos de proporcionar um benefício estatisticamente significativo, que é um padrão muito inferior, o registro de eficácia da brexpiprazole foi de uma espécie marginal. No estudo da fase II, todas as quatro doses de brexpiprazole não proporcionaram um benefício sobre o placebo. Os estudos da fase III compararam três doses com placebo: uma dose baixa, uma dose de 2 mg, e uma dose de 4 mg. A dose baixa não proporcionou um benefício em ambos os estudos, e a dose de 2 mg não o fez em um dos dois estudos da fase III. Foi somente reunindo os resultados dos estudos da fase III que a dose de 2 mg subiu para a categoria “estatisticamente significativa”.
Na análise conjunta, os 2 mg proporcionaram apenas uma diferença de 5,46 pontos na redução dos sintomas em relação ao placebo, e os 4 mg apenas uma diferença de 6,69 pontos. Três estudos de brexpiprazole, com um total de 10 doses do medicamento em comparação com placebo – este último um grupo composto de pacientes crônicos retirados de seus medicamentos antipsicóticos – e nem uma única vez uma dose forneceu um benefício clinicamente significativo.
A árvore do dinheiro
Após a publicação dos resultados das fases II e III, Citrome escreveu vários artigos sobre brexpiprazole, revendo seu mecanismo de ação, eficácia em aspectos secundários, e assim por diante, tudo isso o levou a concluir que brexpiprazole “pode ser particularmente benéfico para pacientes que lutam com inquietação ou acatisia durante testes de medicamentos passados ou aqueles que estão procurando por um medicamento alternativo que não seja altamente sedante”.
Aqui está o dinheiro que fluiu para Kane, Correll e Citrome para serviços de consultoria e/ou de palestras relacionados à brexpiprazole de 2015 a 2018 (banco de dados ProPublica) e o total que receberam de Lundbeck e Otsuka de 2014 a 2020 (banco de dados de pagamentos abertos).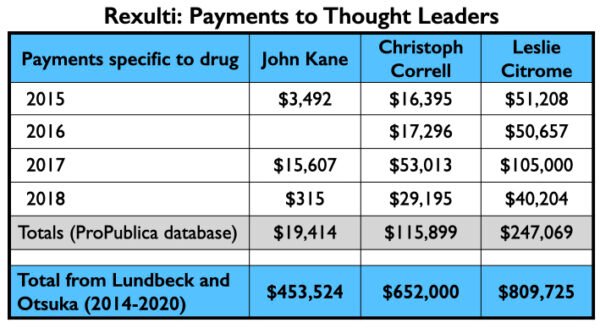
Como Otsuka e Lundbeck já haviam colocado a Abilify Maintena no mercado, mais uma vez eles empregaram regularmente o mesmo quarteto de alto-falantes: Roma, Nguyen, Brams, e El-Mallakh. Entretanto, seu principal orador Rexulti de 2015 a 2018 pode ter sido Gregory Mattingly, um psiquiatra que conduziu testes clínicos para o “Midwest Research Group”.
Aqui está o dinheiro que estes oradores ganharam por promover Rexulti de 2015 a 2018, e o total que ganharam de Lundbeck e Otsuka de 2014 a 2020.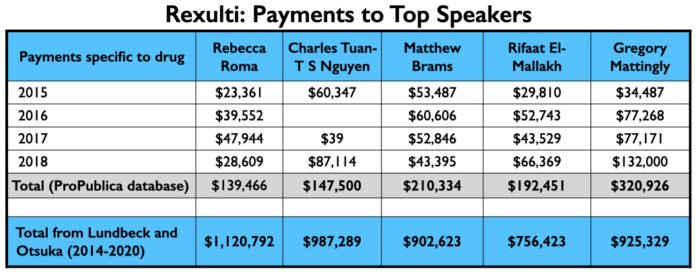
As vendas da Medicaid e Medicare da Rexulti cresceram de forma constante de 2015 a 2019, com mais de US$ 1,4 bilhão em vendas totais.
Vraylar/cariprazina
Havia três empresas envolvidas no desenvolvimento e teste da cariprazina: Gedeon Richter, Laboratórios Florestais, e Allergan. Este medicamento foi aprovada para tratar sintomas de esquizofrenia e mania em pacientes bipolares em 2015, e depressão em pacientes bipolares em 2019. A Allergan o comercializou como Vraylar.
Em seis relatos de estudos fundamentais para esquizofrenia e bipolar, 18 dos 30 autores eram funcionários de uma dessas três empresas. Dois dos 18 funcionários também eram detentores da patente do medicamento. Dos 12 não-empregados nomeados como autores, 11 revelaram laços financeiros com pelo menos uma das empresas. O único investigador que não tinha vínculos, Henry Nasrallah, foi pago posteriormente por Allergan, no valor de 75.823 dólares, principalmente por serviços de fala.
Os resultados publicados
Nos três ensaios fase II/fase III para esquizofrenia, pacientes com histórico de “resistência ao tratamento” de antipsicóticos foram excluídos da inscrição. Os pacientes com primeiro episódio também foram excluídos. Os estudos foram realizados em pacientes crônicos retirados dos antipsicóticos que haviam tomado e depois randomizados para uma das quatro doses de cariprazina ou para placebo. Em uma análise conjunta dos três ensaios, ao final de seis semanas os pacientes com cariprazina tinham visto seus escores de PANSS diminuir de 6,5 para 9,5 pontos a mais do que os pacientes do grupo de placebo (a variabilidade reflete os escores para as diferentes dosagens.) Os pesquisadores concluíram que “a cariprazina foi eficaz versus placebo em todos os cinco domínios do fator PANSS, sugerindo que ela pode ter uma eficácia de amplo espectro em pacientes com esquizofrenia aguda”.
As empresas também realizaram um estudo sobre a cariprazina para reduzir as recidivas. Os pacientes crônicos foram tratados pela primeira vez com cariprazina, e apenas aqueles que se estabilizaram e permaneceram estáveis com o medicamento por 20 semanas foram randomizados no estudo duplo-cego. Nos meses seguintes, a taxa de recidivas foi duas vezes maior para o grupo de placebo retirado do que para o grupo mantido com cariprazina (48% contra 25%). “O tratamento de longo prazo com cariprazina foi significativamente mais eficaz que o placebo para a prevenção de recaídas em pacientes com esquizofrenia”, os autores concluíram.
Em três estudos centrais de cariprazina para depressão em bipolar 1, houve sete comparações de cariprazina com placebo (nas doses de 0,75 mg, 1,5 mg e 3 mg). Em quatro das sete comparações, a cariprazina proporcionou um benefício estatisticamente significativo, e nas outras três não o fez. Nas quatro comparações “bem-sucedidas”, a diferença na redução dos sintomas entre droga e placebo variou de 2,4 a 4,0 pontos na escala de 60 pontos do MADRS. Cariprazina “foi eficaz, geralmente bem tolerada e relativamente segura na redução de sintomas depressivos em adultos com depressão bipolar 1”, os pesquisadores concluíram.
A crítica
Os ensaios fase II/fase III de cariprazina foram semelhantes em design aos ensaios brexpiprazole: Os pacientes do primeiro episódio foram excluídos; doses múltiplas do medicamento foram comparadas com uma única dose de placebo; e o grupo placebo foi composto de pacientes crônicos que haviam sido abruptamente retirados de seu medicamento antipsicótico. Além disso, apenas pacientes que haviam respondido bem aos antipsicóticos foram permitidos no estudo (por exemplo, pessoas com histórico de uma resposta ruim foram excluídas). Os dados reunidos falavam de uma eficácia semelhante à do brexpiprazol a 2 mg e 4 mg: As diferenças na escala PANSS foram forma consideradas estatisticamente significativas, mas ficaram aquém dos 15 pontos de “diferença mínima clinicamente importante”.
O estudo de recidiva foi realizado em um grupo seleto de bons respondedores à cariprazina. Dos 765 pacientes crônicos inscritos no estudo, apenas 200 estabilizaram com sucesso em cariprazina e permaneceram estáveis durante as 20 semanas necessárias antes de serem aleatorizados no ensaio duplo-cego. Apenas 18 dos aleatorizados à cariprazina completaram o estudo de 72 semanas de recaídas; os 89 restantes no grupo da droga, ou recaíram, ou a interromperam devido a eventos adversos, ou retiraram seu consentimento, ou foram perdidos para acompanhamento.
Em suma, apenas 26% dos pacientes crônicos recrutados no estudo estabilizaram em tempo suficiente para entrar no estudo de recidiva, e dos 101 então randomizados para continuar o tratamento com cariprazina, 82% não conseguiram terminar o estudo. Essa é uma taxa documentada de permanência bem documentada de 72 semanas para o grupo tratado com cariprazina de 3%.
Quanto aos estudos da cariprazina como tratamento para depressão em pacientes bipolares, apenas quatro das sete dosagens proporcionaram um benefício estatisticamente significativo, e a diferença na redução dos sintomas na escala MADRS entre o medicamento e o placebo, mesmo naqueles casos em que a diferença foi estatisticamente significativa, foi de um tipo marginal.
Também é digno de nota que cinco dos seis principais autores de relatórios analisados pela MIA eram funcionários da empresa. Um ou ambos os proprietários da patente do medicamento foram listados como autores em cinco dos relatórios.
A árvore do dinheiro
Aqui está o dinheiro que fluiu para os cinco psiquiatras americanos nomeados como autores em um ou mais dos seis estudos publicados, e para Leslie Citrome, que publicou 17 artigos sobre cariprazina, incluindo 10 onde ele foi o único autor.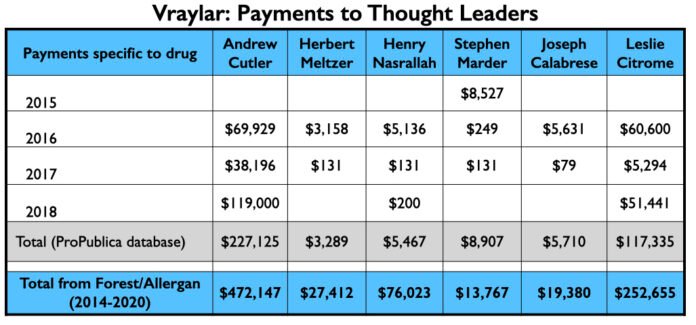
Os quatro psiquiatras no topo da lista de oradores do Vraylar são todos nomes familiares do clube do milhão de dólares. As vendas de Medicare e Medicaid totalizaram US$ 1,18 bilhões durante os primeiros quatro anos do medicamento no mercado.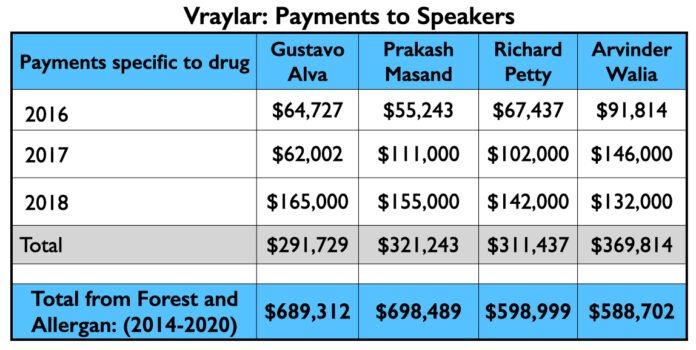
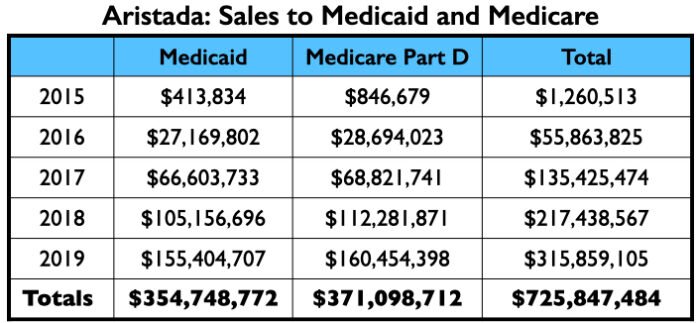
 Aristada/aripipiprazole lauroxil
Aristada/aripipiprazole lauroxil
Alkermes obteve a aprovação da FDA para o aripiprazole lauroxil em 2015, comercializando-o como Aristada. Esta foi uma segunda forma injetável de aripiprazole, comercializada como sendo uma melhoria em relação ao Abilify Maintena, uma vez que dura mais tempo no corpo.
Em um relatório sobre o estudo de Fase III, que foi publicado no Journal of Clinical Psychiatry, oito dos dez autores eram funcionários da Alkermes. Os dois não-empregados eram os psiquiatras americanos Herbert Meltzer e Henry Nasrallah. Meltzer foi consultor da Alkermes durante o estudo; Nasrallah foi consultor da empresa e de seu gabinete de oradores.
Os resultados publicados
Os pacientes crônicos recrutados para o estudo precisavam ter tido uma “resposta clinicamente benéfica” prévia a um antipsicótico. Os pacientes que anteriormente tinham uma “resposta inadequada ao aripiprazole oral” foram excluídos. Após serem retirados dos medicamentos antipsicóticos que haviam tomado, os pacientes inscritos foram randomizados para lauroxil aripiprazole ou para placebo. Aqueles randomizados para o aripiprazol injetável também receberam uma dose oral de aripiprazol durante as primeiras três semanas.
Ao final de 12 semanas, a pontuação do PANSS no grupo injetável havia diminuído 22 pontos, o que foi 12 pontos a mais do que a diminuição no grupo placebo. “Este estudo demonstrou uma eficácia robusta de doses múltiplas de aripiprazole lauroxil com um perfil de segurança e tolerabilidade do aripiprazole oral”, escreveu Meltzer, Nasrallah, e os funcionários da empresa. “O perfil clínico do aripiprazol combinado com a flexibilidade proporcionada pela nova tecnologia e capacidade de administrar nos músculos deltóide e glúteo pode representar uma nova opção de tratamento tanto para os clínicos quanto para seus pacientes com esquizofrenia”.
Leslie Citrome, Andrew Cutler e Nasrallah, juntamente com quatro funcionários da Alkermes, publicaram posteriormente uma análise adicional dos dados da fase III em CNS Spectrums que forneceram informações sobre “pontos finais de eficácia de apoio”.
A crítica
Este estudo da fase III teve o desenho habitual para um ensaio antipsicótico: Pacientes crônicos com histórico de resposta positiva a um antipsicótico foram abruptamente retirados de um medicamento antipsicótico, e então foi feita uma comparação entre aqueles que foram colocados de volta em um antipsicótico e aqueles que ficaram em estado de abstinência de drogas. O resultado é quase sempre o mesmo. As vias neurais no cérebro desses pacientes crônicos se adaptaram à presença de drogas bloqueadoras de dopamina e, portanto, aqueles colocados novamente em uma droga com esse mecanismo de ação terão uma redução maior dos sintomas no PANSS do que o grupo “placebo”.
Este desenho também garante que o grupo de placebo – visto que é um grupo que retirou o medicamento – sofrerá freqüentemente de “eventos adversos”. Neste estudo, a porcentagem de pacientes que sofreram um “evento adverso emergente do tratamento” foi maior para o grupo placebo (62,3%), o que incluiu eventos como insônia, acatisia, dor de cabeça e ansiedade. Esta alta incidência de eventos adversos no grupo placebo ajuda a fornecer informações para avaliar o tratamento medicamentoso como relativamente seguro e tolerável. (Este mesmo fator pode ser visto nos estudos de brexpiprazole e cariprazina).
Este também não foi um ensaio do lauroxil de aripiprazol como tratamento autônomo. A diferença na diminuição da pontuação do PANSS entre os grupos do medicamento e placebo ocorreu principalmente nas primeiras três semanas, quando os pacientes com aripiprazol lauroxil também estavam sendo tratados com aripiprazol oral. Uma vez apenas no injetável, houve pouca diminuição contínua em seus escores de PANSS.
Embora a diferença de 12 pontos nos escores do PANSS no final das 12 semanas fosse estatisticamente significativa, ela ainda ficou aquém da “diferença mínima clinicamente importante” de 15 pontos. De fato, ao final de 12 semanas, a pontuação média do PANSS para os pacientes com lauroxil aripiprazole era de 71, o que está associado a estar “moderadamente doente”. Apenas 36% dos pacientes com lauroxil aripiprazole foram considerados como tendo respondido ao medicamento (uma queda de 30% na pontuação do PANSS), contra 18% dos pacientes com placebo.
A árvore do dinheiro
Aqui está a árvore do dinheiro para Aristada: os pagamentos aos quatro psiquiatras americanos que foram autores dos dois trabalhos; os pagamentos aos três principais palestrantes (além do Citrome, que foi um palestrante ativo do Aristada), e as vendas do Medicaid e do Medicare.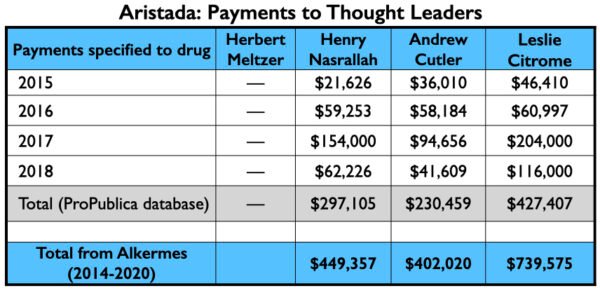
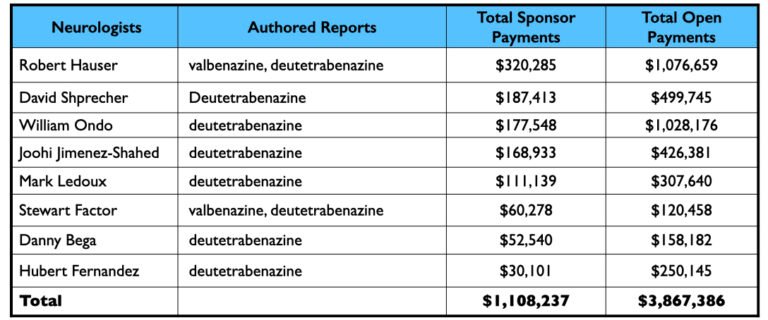
A Teva obteve a aprovação da FDA para o tratamento da discinesia tardia em 2017, comercializando-a como Austedo. A empresa dependia principalmente de neurologistas para testar sua eficácia em acalmar movimentos motores anormais, e depois a promoveu fortemente com psiquiatras que são populares no circuito de palestras.
O relatório publicado de um estudo de 12 semanas listou 15 autores: dois eram funcionários, oito eram neurologistas pagos pela Teva como consultores e/ou palestrantes, outro era um consultor de PhD, e os quatro restantes eram psiquiatras americanos.
Os resultados publicados
No estudo, os pacientes que sofriam de discinesia tardia foram randomizados para dutetrabenazina ou para placebo. Eles foram autorizados a continuar tomando os medicamentos psiquiátricos que estavam tomando. Ao final de 12 semanas, o grupo de dutetrabenazina sofreu uma queda de 3,0 pontos na Escala de Movimento Involuntário Anormal (AIMS), em comparação com uma queda de 1,6 pontos para placebo, uma diferença que foi estatisticamente significativa. “Em pacientes com TD, a dutetrabenazina foi bem tolerada e reduziu significativamente os movimentos anormais”, concluíram os autores.
A crítica
A AIMS avalia a função motora em sete áreas, com pontuação de zero a quatro em cada domínio. Uma pontuação total de 7 na escala de 28 pontos indica sintomas mínimos, com movimentos anormais “infrequentes e não fáceis de detectar”. Uma pontuação total de 14 indica movimentos anormais “leves” do TD que são “infrequentes, mas fáceis de detectar”.
A pontuação média da AIMS para os pacientes no ensaio de 12 semanas foi 9,6, o que significa que este estudo foi realizado em um grupo com sintomas mínimos a leves. A diferença de 1,4 pontos na redução dos sintomas entre droga e placebo, embora estatisticamente significativa, não seria de importância clínica “mínima”. Os pesquisadores determinaram que é necessário haver pelo menos uma diferença de 2 pontos no AIMS para que ela seja clinicamente significativa.
Além disso, em duas outras escalas de eficácia secundária que foram utilizadas, a Impressão Clínica Global de Mudança [Clinical Global Impression] e a Impressão Paciente Global de Mudança [Patient Clinical Global Impression of Change], as diferenças na melhoria entre os grupos de dupla trabenazina e placebo não foram estatisticamente significativas. Nem os investigadores nem os pacientes, quando solicitados a dar sua impressão de que tinham melhorado ou permanecido na mesma ou piorado com o medicamento, notaram uma diferença.
A árvore do dinheiro
Aqui está o dinheiro que Teva havia pago aos oito neurologistas até o final de 2020 por seus serviços de consultoria ou de palestra: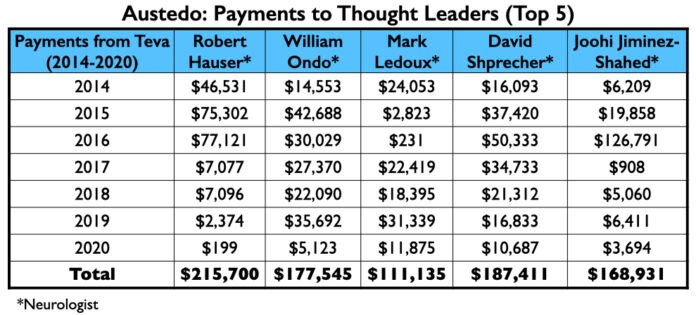
A lista de palestrantes de Teva apresentava quatro psiquiatras do clube do milhão de dólares: Richard Jackson, Rakesh Jain, Arvinder Walia, e Andrew Cutler.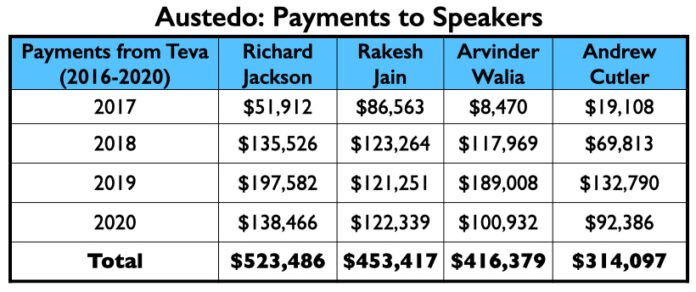
Em seus dois primeiros anos completos no mercado, a Austedo gerou quase US$ 600 milhões em vendas de Medicaid e Medicare.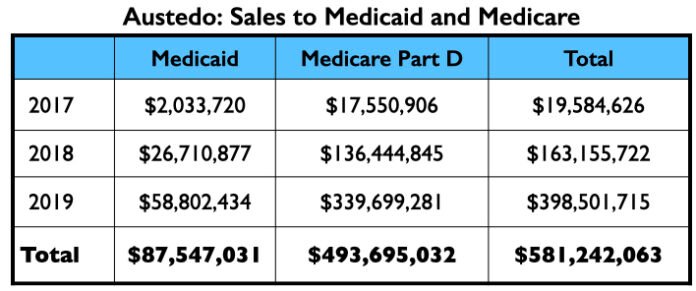
Ingrezza/valbenazina
Valbenazina, que foi desenvolvida pela Neurocrine Biosciences e comercializada como Ingrezza, foi aprovada ao mesmo tempo em que a dutetrabenazina como tratamento para a discinesia tardia.
Quatro dos nove autores de um relatório de fase III sobre valbenazina eram funcionários da Neurocrina. Quatro outros tinham vínculos financeiros com a empresa, incluindo o autor principal, o neurologista Robert Hauser.
Os resultados publicados
No estudo da fase III, duas doses de valbenazina foram comparadas com placebo. A dose de 80 mg levou a uma queda dos sintomas de 3,2 pontos na escala AIMS em seis semanas; a dose de 40 mg a uma queda de 1,9 pontos. Como o grupo de placebo neste estudo não melhorou (.1 ponto de diminuição dos sintomas), a diferença de 3,1 pontos entre a dose de 80 mg de valbenazina e placebo foi mais robusta do que os resultados dos ensaios com dutetrabenazina. “Tomada uma vez por dia, a valbenazina melhorou significativamente a discinesia tardia em participantes com esquizofrenia subjacente, distúrbio esquizoafetivo ou transtorno de humor”, os pesquisadores concluíram.
A crítica
Os pacientes deste estudo tinham um escore AIMS médio de 10,0, e portanto era um grupo com sintomas mínimos a leves. Enquanto o escore AIMS em ambas as doses apresentava um benefício estatisticamente significativo, apenas a dose de 80 mg excedia a diferença de dois pontos para uma “diferença mínima clinicamente importante”.
Com referência aos aspectos secundários, o “Clinical Global Impression of Change-Tardive Dyskinesia”, não houve diferenças significativas entre a dose de drogas ou placebo na sexta semana. Esta é uma avaliação pelos clínicos da mudança geral no estado clínico dos pacientes, variando de muito melhorada a muito pior, em uma escala de um a sete. O fato de que não houve diferença significativa nesta escala revela que os investigadores, neste ensaio duplo-cego, não notaram uma diferença clínica nos dois grupos em nenhuma das doses.
A árvore do dinheiro
Os pagamentos da Neurocrine a seus líderes de pensamento foram geralmente inferiores ao que os líderes de pensamento para os outros seis medicamentos aprovados de 2013 a 2017 foram pagos.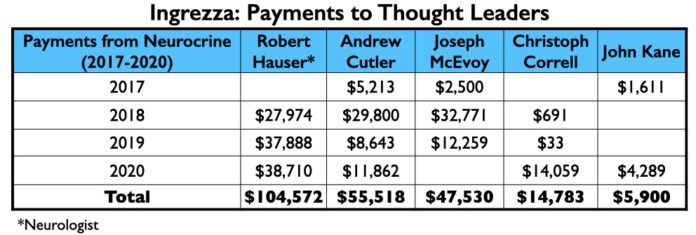
No entanto, os quatro primeiros da lista de palestrantes incluíam três do clube do milhão de dólares (Citrome, Jain e Reynolds), e um quarto que não perdeu essa marca por muito, Craig T. Chepke. Tanto Citrome quanto Chepke escreveram artigos sobre valbenazine, com Chepke’s publicados no CNS Spectrums.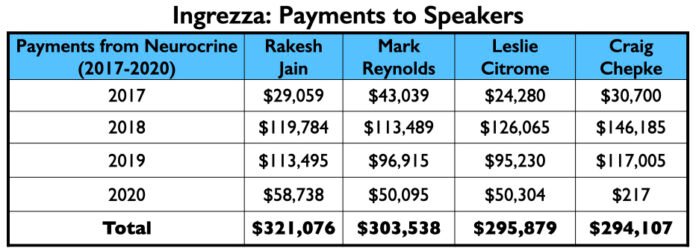
Ingrezza teve um rápido aumento nas vendas, gerando mais de US$ 1 bilhão em pagamentos de Medicaid e Medicare em seus dois primeiros anos completos no mercado.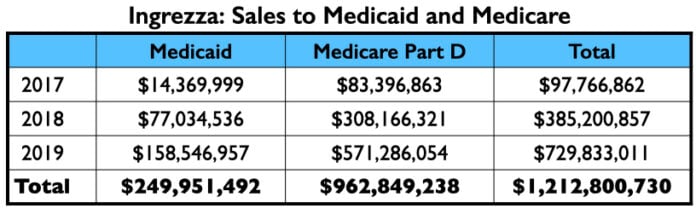
O Resultado Final
O banco de dados de Pagamentos Abertos permite descobrir a quantidade de dinheiro farmacêutico pago a psiquiatras individuais durante os testes e a comercialização de novos medicamentos. O que esta revisão revela é que o dinheiro flui para os consultores e assessores que ajudam as empresas a projetar seus ensaios e a escrever artigos sobre os resultados; flui para aqueles que publicam revisões e análises adicionais do novo medicamento uma vez que os resultados dos ensaios são publicados; e flui para aqueles que atuam em gabinetes de palestrantes.
Embora os US$ 340 milhões que as empresas farmacêuticas pagaram aos psiquiatras de 2014 a 2020 possam ter proporcionado aos psiquiatras individuais ganhos substanciais, trata-se de uma pequena despesa para as empresas farmacêuticas. Os pagamentos alimentam o discurso de uma narrativa, envolta em uma atmosfera científica de “ensaios duplo-cegos, controlados por placebo, randomizados”, de medicamentos que são seguros e eficazes para uma determinada condição, com possíveis vantagens sobre os medicamentos existentes. Como pode ser visto nos pagamentos do Medicaid e do Medicare para os sete medicamentos aprovados, esta narrativa gera então bilhões em vendas.
O que esta crítica também revela é que o teste de medicamentos psiquiátricos é uma farsa. É um processo concebido para não informar, mas – desde que o medicamento passe pela revisão da FDA – produzir uma mordida sonora comercialmente valiosa. Estes estudos foram repletos de elementos de má ciência.
Os estudos dos quatro antipsicóticos utilizaram todos critérios de inclusão e exclusão para selecionar um grupo de potencialmente “boas respostas” aos medicamentos e, em vários casos, selecionados para um grupo que tinha se estabilizado bem no medicamento em estudo por vários meses antes da randomização.
A exclusão de pacientes do primeiro episódio de tais ensaios também é de se notar. Se o antipsicótico é inovador, este é o próprio grupo que poderia fornecer um teste real de se um antipsicótico reduziu melhor os sintomas do que o placebo. Uma revisão da Cochrane concluiu em 2011 mostrou que não há, de fato, nenhuma boa evidência de que os antipsicóticos sejam eficazes em pacientes com primeiro episódio. Excluindo tais pacientes de seus testes e inscrevendo apenas pacientes crônicos, as empresas farmacêuticas podem esperar que eles sejam poupados de tal falha.
Os ensaios de antipsicóticos, naturalmente, quase sempre dependeram de grupos de placebo compostos de pacientes abruptamente retirados de tais medicamentos (ou retirados durante um período de sete dias). Aqui está a dimensão moral para julgar esta prática: Se um psiquiatra na prática diária retirasse abruptamente um paciente com esquizofrenia crônica da medicação antipsicótica e depois deixasse essa pessoa sem tratamento por semanas e meses, isso seria visto como negligência médica. No entanto, esse mesmo ato de má prática clínica está no centro de ensaios controlados aleatórios de antipsicóticos, e todos fazem vista grossa a esse fato e fingem que o grupo retirado reflete o curso “não tratado” da esquizofrenia. O rei, por assim dizer, está completamente nu, e ainda assim a comunidade psiquiátrica, ao recitar “provas de ensaios duplo-cegos, controlados por placebo e randomizados”, finge que o rei está vestido com uma roupa científica resplandecente.
O aspecto mais notável dos ensaios clínicos de brexpiprazole e cariprazina é que, mesmo com os critérios de inclusão/exclusão tendenciosos, e mesmo com o uso de um grupo placebo sob a retirada, estas duas drogas ainda não conseguiram fornecer uma “diferença mínima clinicamente importante” nos sintomas na escala PANSS sobre o placebo.
A falha em fornecer um benefício clinicamente significativo também foi evidente nos estudos da fase III de Aristada e Austedo. Esses dois medicamentos também falharam de cara, assim como o Abilify Maintena no ensaio de manutenção na esquizofrenia. Isso faz com que cinco dos sete medicamentos aprovados não proporcionassem um benefício “mínimo clinicamente importante” nos ensaios clínicos. Quanto a Ingrezza, apenas uma de duas doses atingiu esse padrão, e mesmo com a dose que o fez, as classificações dos clínicos e dos pacientes sobre se tinham melhorado ou piorado não indicaram uma diferença entre os grupos de valbenazina e placebo.
No entanto, nenhuma dessas críticas chegou aos resumos dos relatórios publicados para esses seis medicamentos, nem às conclusões tiradas pelos autores. Não houve discussão sobre a falta de um benefício clínico significativo; ao invés disso, repetidamente, os autores falaram de drogas que se mostraram “seguras e eficazes” em “ensaios aleatórios, duplo-cegos e controlados por placebo”.
Quanto aos ensaios de vortioxetina, Otsuka e Lundbeck, foram publicados apenas aqueles que relataram um achado positivo. O fracasso desta droga nos ensaios nos EUA foi mantido escondido do público, e isto traz à tona outro elemento de má ciência: Como os resultados podem ser confiáveis, dado que os funcionários da empresa estão autorizando os relatórios e decidindo quais resultados devem ser publicados? É possível que nas revisões dos dados da FDA para os outros seis medicamentos também tenham aparecido testes negativos que nunca foram publicados, e que se tais descobertas fossem conhecidas, a relação risco-benefício para os seis pareceria ainda pior.
Tudo isso fala de um processo que serve a um fim comercial, em vez de fornecer à sociedade uma avaliação científica honesta dos riscos e benefícios de um medicamento, e se o benefício é clinicamente significativo. A “estrutura” da ciência é utilizada para enganar o público do que para o informar.
Como uma busca comercial, porém, ela produz este resultado final: os contribuintes americanos gastaram US$ 9,3 bilhões com esses sete medicamentos desde o momento em que foram aprovados até 2019 na forma de pagamentos Medicaid e Medicare, e com base nos números de 2019 e nas taxas de crescimento nas vendas, os contribuintes gastaram outros US$ 5 bilhões em 2020.
E este é o “resultado final” quando se segue o dinheiro: Há dinheiro que flui para os psiquiatras individuais e para as empresas farmacêuticas, e no coração deste empreendimento comercial está a “ciência” destinada a enganar.
[Publicado originalmente no MIA. Tradução e edição: Fernando Freitas]